일리노이 주 노스 시카고 애브비는 지난 10월 31일 제3상 임상시험 SELECT-PsA 2의 긍정적인 주요 결과를 발표했다.
이 임상연구에서는 한가지 이상의 생물학적 항류마티스제(bDMARDs)에 불충분한 반응을 보인 성인 활성 건선관절염 환자를 대상으로 두 가지 용량(1일 1회, 15mg 또는 30mg)의 유파다시티닙을 투여한 결과, 위약군에 비해 12주차의 1차 유효성 평가 변수인 ACR20 도달률이 높은 것으로 나타났다. 또한, 주요 2차 유효성 평가변수를 만족하는 비율은 두 가지 용량의 유파다시티닙 투여군이 위약군보다 유의미하게 높았다.
| SELECT-PsA 2연구는 성인 활성 건선관절염 환자를 대상으로 유파다시티닙의 유효성과 안전성을 평가한 첫 번째 임상연구이다. 유파다시티닙은 애브비가 개발한 선택적 및 가역적 JAK 억제제로, 건선관절염 및 다양한 면역 매개 질환에 대해 1일 1회 용법으로 연구 진행 중이다. |
애브비의 부회장 마이클 세버리노(Michael Severino) 의학박사는 “아직 치료 목표에 도달하지 못하고 있는 건선관절염 환자들이 많은데, 이는 혁신적인 치료제에 대한 미충족 수요가 있다는 것을 의미하는 것”이라며 “이번 시험을 통해 유파다시티닙이 다양한 증상을 가진 건선관절염 환자의 치료 결과를 개선할 수 있다는 것을 확인해 기쁘게 생각한다. 이번 3상 시험의 데이터는 유파다시티닙이 건선관절염 치료제로 허가 받기 위한 근거 자료가 될 것”이라고 말했다.
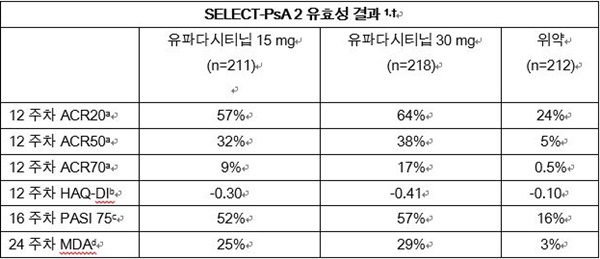
연구 결과, 12주차에 ACR20에 도달한 비율은 유파다시티닙 15mg 투여군에서 57%, 30mg 투여군에서 64%, 위약군은 24%였다(p<0.0001). 12주차의 ACR50 달성률은 유파다시티닙 15mg 투여군 32%, 30mg 투여군 38%였고, 그에 대비해 위약군 5%였다(p<0.0001).
12주차에 ACR70에 도달한 비율은 유파다시티닙 15mg 투여군 9%, 30mg 투여군 17%였지만, 위약군 0.5%에 그쳤다.(p<0.0001). 유파다시티닙 투여군의 경우 12주차에 건강평가 설문 장애지수(health assessment questionnaire disability index, HAQ-DI)를 통해 평가한 신체기능도 더 크게 호전됐다.
16주차에 75%의 건선 피부상태 호전을 의미하는 PASI75를 달성한 비율은 유파다시티닙 15mg 투여군 52%, 30mg 투여군 57%였고 그에 비해 위약군 16%였다(p<0.0001). 24주차에 유파다시티닙 15mg 투여군의 25%, 30 mg 투여군의 29%가 최소 질병 활성도(MDA)에 도달했고, 위약군은 3%가 이에 도달했다(p<0.0001).
이번 연구에서 유파다시티닙의 안전성 프로파일은 새로운 안전성 문제가 발생하지 않았던 이전의 류마티스관절염 시험에서 관찰된 것과 일치했다. 24주차까지 유파다시티닙 15mg, 30mg 투여군의 심각한 감염 발생률은 각각 0.5%와 2.8%였으며, 위약 투여군은 0.5%였다.
유파다시티닙 15mg 투여군 중 1명에서 폐색전증이 보고됐으며, 30mg 투여군과 위약군에서는 보고되지 않았다. 유파다시티닙 15mg 투여군에서 치명적이지 않은 확인된 주요 심혈관 사건(MACE)이 1건(급성 심근경색증) 발생했고, 30mg 투여군과 위약군에서는 발생하지 않았다. 사망은 위약군에서 1건(교통사고) 보고됐다.
| SELECT-PsA 2 임상연구 SELECT-PsA 2연구는 한가지 이상의 생물학적 항류마티스제제에 대해 불충분한 반응을 보인 성인 활성 건선관절염 환자를 대상으로 유파다시티닙의 안전성과 유효성을 평가하기 위해 설계된 제3상, 다기관, 무작위 배정, 이중맹검, 병행 투여군, 위약대조 시험이다. 환자들은 유파다시티닙 15mg, 유파다시티닙 30mg 또는 위약을 투여받은 뒤 24주차부터 유파다시티닙 15mg 또는 유파다시티닙 30mg 투여군으로 무작위 배정됐다. 1차 유효성 평가변수는 투여 12주차에 ACR20에 도달하는 환자의 비율이었다. 2차 유효성 평가변수는 투여 시작점 대비 HAQ-DI의 변화, 12주차에 ACR50 및 ACR70에 도달하는 환자의 비율, 16주차에 PASI75에 도달하는 환자의 비율, 그리고 24주차에 MDA에 도달하는 환자의 비율을 포함했다. 해당 연구는 계속 진행되고 있으며 장기간 확장 시험은 위약대조 기간이 끝난 환자에 대한 유파다시티닙의 장기적 안전성, 내약성 및 유효성을 평가하기 위해 맹검을 유지한 상태로 진행된다. |
건선관절염은 전세계 5천만명 이상이 앓고 있으며, 전신 여러 곳에 염증이 발생하는 질환으로 관절과 피부에 특징적인 증상이 나타난다. 건선관절염 환자의 면역 시스템에서 염증을 유발해 통증, 피로 및 관절경직을 유발할 수 있다.
SELECT-PsA 2 임상연구의 전체 결과는 향후 의료전문가 미팅에서 발표되고 동료심사 논문으로 게재될 예정이다.
우정헌 기자 mtjpost@mtjpost.com
<저작권자 © 메디트리트저널(THE MEDI TRET JOURNAL), 무단 전재 및 재배포 금지>

