식품의약품안전처는 잔탁(Zantac) 제품과 잔탁에 사용하는 원료제조소에서 생산된 라니티딘을 검사한 결과, 'N-니트로소디메틸아민(NDMA)'이 검출되지 않았다고 16일 밝혔다.
| * NDMA는 WHO 국제 암연구소(IARC) 2A 물질(인간에게 발암물질로 작용할 가능성 있는 물질) |
식약처는 미국 FDA와 유럽의약품청(EMA)이 9월 14일(현지기준 9월 13일) 글락소스미스클라인(GSK)의 잔탁에서 NDMA가 검출됐다는 위해정보를 입수하고, 미국 FDA가 미량 검출됐다고 발표한 라니티딘 제품 중 우선 한국 GSK가 허가 받은 잔탁 3개 품목 잔탁정 75mg(일반의약품), 잔탁정 150mg(전문의약품), 잔탁주 2mL(주사제) 29개 제품(제조번호)과 잔탁에 사용된 원료 라니티딘(6개), 총 35개를 긴급하게 수거·검사를 실시했다.
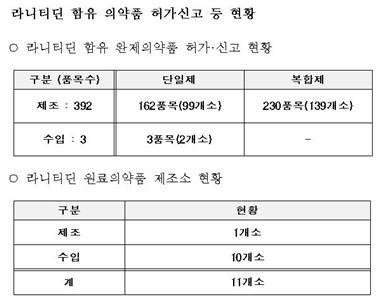
또한, 현재 수입 또는 국내 제조되는 모든 라니티딘 원료(원료제조소 기준으로 11개소)<표 사진>와 해당 원료를 사용한 의약품(395품목)<표>을 대상으로 계속해서 수거·검사를 확대 실시할 계획이다.
아울러, 식약처는 각국의 NDMA 검출 정보를 공유하고 라니티딘 중 NDMA 발생원인 등을 밝히기 위해 미국 FDA와 유럽 EMA 등 각국 규제기관과 긴밀히 협력하고 있다.
미국 FDA 및 유럽 EMA에서는 일부 라니티딘 함유 제제에서 낮은 수준(low level)의 NDMA가 검출됐기 때문에 회수 등 조치는 하고 있지 않은 상황이며, 지속적으로 안전성을 조사할 예정이라고 밝힌 바 있다.
우정헌 기자 medi@mediherald.com
<저작권자 © 메디컬헤럴드, 무단 전재 및 재배포 금지>

